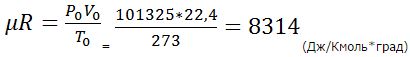Идеальный газ точно подчиняется уравнению Клапейрона, и поэтому оно называется уравнением состояния идеального газа. Для одного кг газа уравнение Клапейрона имеет вид:
pv = RT (6.20)
Если проанализировать физический смысл газовой постоянной:
R = pv/T (6.21)
где pv – это удельная механическая работа, полученная в результате расширения 1 кг газа,
то R – это удельная работа расширения 1 кг газа при нагревании его на один градус, (Дж/кг·К).
[Киломоль (Кмоль, килограмм – молекула)- это количество килограммов вещества, численно равное его молекулярной массе].
Для этого умножим обе части уравнения (6.20) на массу одного Киломоля µ (кг/Кмоль)
pvµ = µRT (6.22)
Произведение vµ представляет собой объём одного Киломоля газа:
vµ = V; (м3/Кмоль) (6.23)
Идеальные газы подчиняются закону Авогадро. При одинаковых температурах и давлениях объёмы, занимаемые одним Киломолем любого идеального газа одинаковы. При нормальных условиях (при P0 = 101325 Па и T0 = 273 К) один Киломоль идеального газа занимает объём Vµ = 22,4 м3/Кмоль и если подставить эти значения в уравнение (6.22), то окажется что произведение µR является величиной постоянной:
Так как эта величина µR одинакова для всех идеальных газов, она называется универсальной газовой постоянной и обозначается Rµ
µR = Rµ = 8314 (Дж/Кмоль*град) (6.24)
Уравнение (6.22) можно представить в виде:
pVµ = 8314 Т (6.25)
Уравнение (6.24) называется уравнением Менделеева – Клапейрона.
Зная константу Rµ = 8314 можно определить величину газовой постоянной для одного килограмма любого газа:
R = 8314/µ (Дж/кг*град) (6.26)
Из закона Авогадро вытекает, что плотность газов при одинаковых значениях давления P и температуры T прямо пропорциональна их молярным массам:
p1/p2 = µ1/µ2 (6.27)
Отношение плотностей можно заменить обратным отношением удельных объёмов:
v2/v1 = µ1/µ2 (6.28)
откуда
v1µ1 = v2µ2 (6.28)