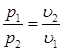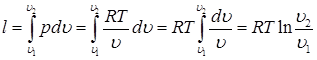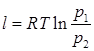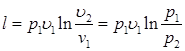Термодинамический процесс, протекающий при постоянной температуре называется изотермическим (изос – равный, термо – тепло). Из уравнения состояния идеального газа pv = RT следует, что при T = const:
pv = const (7.8)
Давление в изотермическом процессе обратно пропорционально удельному объему (7.9):
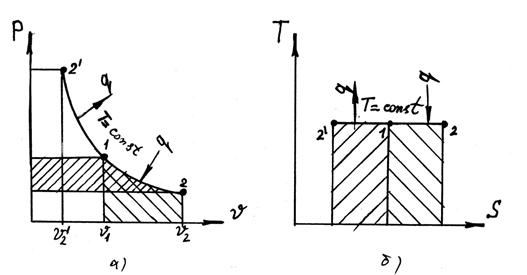
В p — v диаграмме (рис. 7.3) уравнение pv = const изображается равнобокой гиперболой, в T — S координатах изотермический процесс – прямая линия, параллельная оси абсцисс. Приращение внутренней энергии в процессе не происходит, так как при T = const величина ΔT = 0, и следовательно ΔU = 0.
Рис. 7.3 а) рабочая диаграмма изотермического процесса; б) тепловая диаграмма изотермического процесса.
Работа процесса (7.10):
Вместо v2/v1 в выражении (7.10) можно подставить p1/p2. И тогда (7.11):
Уравнение (7.11) можно представить в виде (7.12):
Так как приращение внутренней энергии не происходит, то внесенная в процесс теплота трансформируется в работу. С термодинамической точки зрения изотермический процесс является наиболее совершенным процессом.