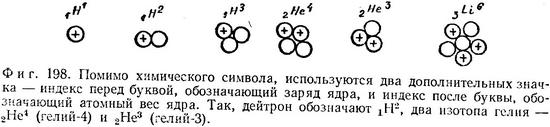Атомное ядро. Из экспериментов по рассеянию α-частиц Резерфорд заключил, что положительный заряд атома сосредоточен в небольшом тяжелом центре, радиус которого меньше 10-12 см. Ему не удалось сразу же установить, состоит ли ядро из одной положительно заряженной частицы или оно является системой нескольких положительных зарядов, в 1911 г. полный заряд ядра не был еще точно известен. В статье, опубликованной в 1911 г., Резерфорд мог ничего не писать о предполагаемой структуре атомного ядра. Однако он не удержался и выдвинул свое объяснение излучения α-частиц.
«Следует заметить, что найденное приблизительное значение центрального заряда атома золота (100 е) порядка той величины, которой равнялся бы этот заряд, если бы он состоял из 49 атомов гелия, каждый из которых имел бы заряд в 2 е. Возможно, что это простое совпадение, однако такой вывод является соблазнительным, поскольку из радиоактивного вещества наблюдается выход атомов гелия [α-частиц], несущих два единичных заряда».
Мысль о том, что каждый элемент состоит из других, отнюдь не была новой. Еще в 1815 г. Уильям Проут предположил, что все элементы состоят из атомов водорода. Эти атомы считались «первоматерией», из которой построена вся остальная материя. Позднее, когда установили, что веса почти всех элементов кратны весу атома водорода, эта идея возродилась вновь. В 1886 г. Уильям Крукс выдвинул предположение, что все атомы состоят из некой первичной субстанции, названной им «protyle». Все попытки такого рода преследовали цель найти такую первичную материю, при помощи которой можно было бы экономично и успешно объединить все известные в то время опытные данные. Теперь мы знаем, что атомные ядра не состоят ни из а-частиц, как думал Резерфорд, ни из ядер водородных атомов, как предполагал Проут. Считается, что ядро содержит тяжелые частицы по крайней мере двух типов: протоны, являющиеся положительно заряженными ядрами водородных атомов, с массой примерно в 1800 раз больше массы электрона, и нейтроны, или нейтральные частицы, масса которых приблизительно равна массе протона; обе эти частицы называются нуклонами. Ядро атома гелия состоит из двух протонов и двух нейтронов, и именно такие ядра вылетают при излучении α-частиц.
В 1902 г. Резерфорд и Фредерик Содди обнаружили, что при распаде радиоактивных элементов их химические свойства меняются. Содди потратил десять последующих лет на изучение этого явления и нашел, что некоторые продукты радиоактивных превращений иногда обладают одинаковыми химическими свойствами, хотя их атомные веса различаются между собой. Так, в 1910 г. Содди безуспешно пытался химически разделить элементы радий и мезоторий, который был продуктом распада тория. В своей Нобелевской лекции в 1921 г. он вспоминал:
«С этого времени (1910 г.) я был убежден, что неразделимость радиоэлементов представляет собой совершенно новое явление… что эти элементы, не просто обладают сходными свойствами, а являются химически тождественными».
В то время Содди не представлял, чем объяснить это явление. Ведь Резерфорд считал, что «величина центрального заряда пропорциональна атомному весу», хотя такая закономерность выполнялась лишь приблизительно. Так как величина центрального заряда определяет химические свойства элемента (количество электронов в атоме), утверждение Резерфорда противоречило результатам Содди, который обнаружил химически одинаковые элементы, имеющие разные атомные веса, в то время как, согласно Резерфорду, их химические свойства должны были быть тоже различными.
Впервые правильное предположение было выдвинуто одним голландским физиком-любителем по фамилии Ван дер Брук, который указал, что «… согласно теории Резерфорда, отношение величины рассеяния α-частицы, приходящейся на один атом, к квадрату ядерного заряда должно быть постоянной величиной». Тем не менее это отношение, вычисленное Гейгером и Марсденом в предположении, что заряд пропорционален атомному весу, менялось от элемента к элементу. Ван дер Брук выдвинул предположение, что заряд пропорционален не атомному весу, а номеру элемента в периодической таблице или атомному номеру. Резерфорд отнесся к этому предположению скептически: «… забавный домысел, не имеющий под собой достаточного основания».
Однако Содди удалось показать, насколько плодотворным было это предположение (неважно, имело оно или нет под собой достаточное основание); в процессе своих исследований Содди ввел понятие об изотопах, или элементах, обладающих различными атомными весами, но занимающих одно и то же место в периодической таблице, а, следовательно, имеющих одинаковые химические свойства. Поддерживая предположение Ван дер Брука, Содди писал:
«Последовательное испускание одной α-частицы и двух β-частиц в процессе трех радиоактивных превращений (независимо от того, в какой последовательности испускаются частицы) приводит к тому, что значение внутриатомного заряда возвращается в исходное место периодической таблицы, хотя атомный вес этого элемента уменьшается при этом на четыре единицы».
На этом основании Содди заключил, что «… центральный заряд в атоме Резерфорда не может быть чисто положительным зарядом…». Содди не был тогда в состоянии ввести новую частицу — нейтрон. Поэтому он постулировал, что ядро состоит из α-частиц (возможно, и атомов водорода) и электронов. Электроны, согласно Содди, испускались ядром в виде β-излучения, и, кроме того, их наличие в ядре объясняло тот факт, что заряд ядра, как правило, был меньше половины атомного веса, следовавшего из предположения, что ядра состоят только из α-частиц.
Таким образом, к 1913 г. сложилось следующее представление о строении атомного ядра. Считалось, что оно содержит достаточное количество α-частиц, необходимое для объяснения атомного веса элемента, и достаточное количество электронов, необходимое для попадания элемента в нужное место периодической таблицы. Эта схема работала относительно хорошо; исключение составляли только некоторые особые случаи, например, выбивание ядер водорода из ядер других элементов. В 1919 г. Резерфорд сообщил о первом искусственном превращении одного элемента в другой. Он бомбардировал атомы азота высокоэнергичными α-частицами и, к своему удивлению, обнаружил появление нового излучения, которое он вскоре идентифицировал с ядрами водородных атомов, и превращение азота в кислород. Резерфорд заключил, что:
«…атом азота [ядро] распадается вследствие громадных сил, развивающихся при столкновении с быстрой α-частицей, и что освобождающийся водородный атом образует составную часть ядра азота».
Так в двадцатых годах нашего столетия среди физиков утвердилось мнение, что ядра атомов содержат в себе ядра водородных атомов (названных Резерфордом протонами в 1920 г.). Считалось, что в ядре находится A протонов, где А — атомный вес элемента (такое количество протонов объясняло массу ядра), и (А—Z) электронов, где Z — атомный номер (такое количество электронов объясняло заряд ядра). Такая теория и другие сходные с ней теории, согласно которым ядро могло содержать еще и α-частицы, были тогда общепринятыми, хотя некоторые ученые время от времени и выдвигали предположение о том, что протон-электронные пары суть просто тяжелые нейтральные частицы, которые мы теперь называем нейтронами. В 1920 г. с такой идеей выступил Резерфорд, однако, поскольку в то время не имелось никаких экспериментальных доказательств существования нейтронов (и казалось, что явление испускания β-частиц противоречит такой идее), это предположение никто не рассматривал всерьез.
В 1925 г. Уленбек и Гаудсмит предположили, что электрон обладает собственным угловым моментом — спином, квантовое число которого равно 1/2. Вскоре было показано, что спин протона тоже равен 1/2. Если теперь попытаться «поместить» как протоны, так и электроны в ядра атомов, то возникают затруднения. Например, ядро азота, атомный вес которого равен 14, а атомное число — 7, должно было бы содержать 14 протонов и 7 электронов. Суммарный спин этих частиц не может обратиться в нуль, так как его минимальное значение в случае 21 частицы, каждая из которых имеет спин 1/2, не может быть меньше 1/2. (Спин двух частиц равен 0 или 1; трех частиц — 1/2 или 3/2; четырех частиц — 0, 1 или 2; пяти частиц — 1/2, 3/2 или 5/2 и т. д. В общем случае сумма нечетного числа спинов 1/2 никогда не может обратиться в нуль.) Тем не менее опыт показывал, что спин ядра азота равен нулю. Введя новую частицу — нейтрон, Чэдвик смог объяснить не только этот факт, но и другую трудность старой теории, которая состояла в том, что легкий электрон, находящийся внутри такого малого объема, как атомное ядро, должен был бы обладать, согласно принципу неопределенности, огромной кинетической энергией.
Ранее было показано, что в основном состоянии кинетическая энергия частицы массой m, заключенной в одномерном сосуде длиной l, равна: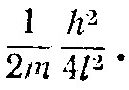
Если частица — электрон, то m≈10-27 г и при l = 10-12 см кинетическая энергия:![]()
Энергия электронов, вылетающих из ядра при β-распаде, порядка 1 МэВ. Такую величину энергии можно было бы объяснить почти точным совпадением между глубиной потенциальной ямы внутри ядра и вычисленной кинетической энергией, если бы это объяснение не выглядело крайне надуманным. В случае же частицы с массой нуклона соответствующая кинетическая энергия порядка 2 МэВ; такая энергия кажется гораздо разумнее.
Введение нейтрона (нейтральной тяжелой частицы с массой, примерно равной массе протона, и со спином 1/2) позволило разрешить упомянутые выше трудности. Так, например, ядро атома азота (атомный вес 14, атомное число 7) можно было теперь считать состоящим из 7 протонов и 7 нейтронов, суммарный спин которых равен нулю. Отпала необходимость в предположении, что внутри ядра находятся электроны, обладающие колоссальной кинетической энергией, и стал понятен тот факт, что изменение атомного веса элемента может не сопровождаться изменением его атомного номера (если из ядра удаляются или в него вносятся нейтроны). Таким образом, после введения нейтрона строение ядер стало таким, каким оно признается по настоящее время (фиг. 198).