В жидких проводниках (электролитах) происходит непрерывный самопроизвольный распад молекул на составные части . Иногда этот процесс называется процессом диссоциации молекул. Например, молекула медного купороса CuS04 распадается на положительный ион меди Cu и отрицательный ион S04 (так называемый кислотный остаток). В электролите происходит беспорядочное тепловое движение ионов и молекул. Ионы соединяются, образуют молекулы, вновь распадаются и т. д. В целом раствор электрически нейтрален, так как количество положительных и отрицательных ионов в нем одинаковое.
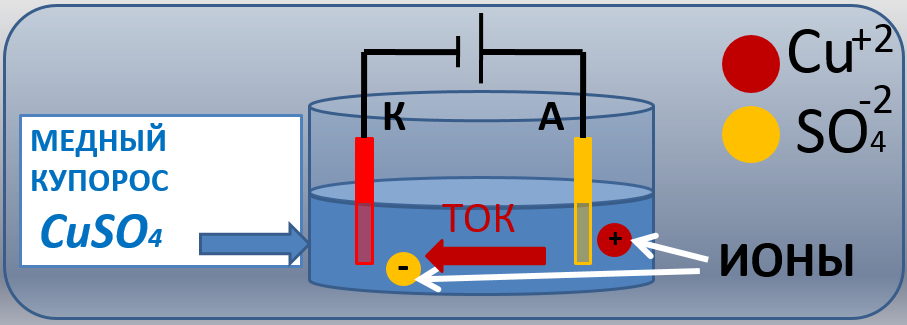
Проделаем следующий опыт. В стеклянный сосуд с раствором медного купороса (CuS04) опустим две медные пластины (электроды) и подключим их к источнику электрической энергии (рис. 1). Пластина, соединенная с положительным полюсом источника, называется анодом (эта пластина имеет положительный потенциал), а другая, соединенная с отрицательным- полюсом,— катодом (эта пластина имеет отрицательный потенциал).
Рисунок 1. Прохождение электрического тока через раствор медного купороса.
Как только мы подключим пластины к источнику электрической энергии, между ними образуется электрическое поле. На положительные и отрицательные ионы, находящиеся в растворе, начнут действовать электрические силы.
Очевидно, что отрицательные ионы (SO4) пойдут к аноду, а положительные (Сu)—к катоду, т. е. в электролите начнется упорядоченное движение ионов. Это упорядоченное движение ионов в электролите под воздействием сил электрического поля и называется ионным электрическим током. Ионный электрический ток существует до тех пор, пока между электродами имеется разность потенциалов.
Мы видим существенное отличие электрического тока в электролите от электрического тока в металлическом проводнике: первый создается движением ионов, а второй — свободных электронов.
Что же будет происходить в электролите после того, как положительные ионы подошли к катоду, а отрицательные — к аноду?
Положительные ионы (Сu) присоединяют недостающие электроны и превращаются в молекулы чистой меди. Молекулы меди в виде тончайшего слоя отлагаются на катоде. Отрицательные ионы отдают излишние электроны аноду и вступают в химическую реакцию с материалом анода, т. е. с медью, образуя молекулы медного купороса (CuSO4). Эти молекулы вступают в электролит.
Таким образом, в электролите при прохождении электрического тока происходит следующий процесс: катод покрывается слоем меди, выделяющейся из электролита, а анод растворяется и пополняет убыль меди в электролите.
Определение: Процесс прохождения ионного электрического тока в электролите, сопровождающийся химическими превращениями вещества и выделением его, получил название электролиза
Честь открытия явления электролиза принадлежит русскому академику Б. С. Якоби. В настоящее время явление электролиза широко применяется в промышленности (очистка металлов, снятие копий с различных предметов, никелирование, золочение, серебрение и т. д.).